Chemie
Př. Vypočítej hmotnost 2 molů hydroxidu sodného. n = 2 mol M (NaOH) = 23 + 16 + 1 = 40 g/mol m (NaOH) = ? (g) m (NaOH)= M (NaOH) . n m(NaOH) = 40 . 2 m (NaOH) = 80 g Hmotnost 2 molů hydroxidu sodného je 80 g. HMOTNOSTNÍ ZLOMEK w - určuje podíl hmotnosti jedné složky směsi na celkové hmotnosti směsi.
Je to bezrozměrné číslo – nemá jednotku. m(s) w …… hmotnostní zlomek w = m(s) …… hmotnost složky směsi m(c) m(c) …… hmotnost celé směsi Obě veličiny hmotnosti musí být ve stejných jednotkách (tuna, kilogram, gram). Hodnota w je vždy w < 1. Proto hmotnostní zlomek velmi často vyjadřujeme v procentech. m(s) w = . 100 [%] m(c) Př. Kolik procent sodíku je vázáno v chloridu sodném? M(Na) = 23 g/mol M(NaCl) = 58,45 g/mol w = ? (%) 23 w = 58,45 w = 0,394 . 100% = 39,4% V chloridu sodném je vázáno asi 39,4% sodíku. Při přípravě roztoků používáme upravený výraz pro výpočet hmotnostního zlomku složky ve směsi: m(s) w = m(s) + m(r) m(s) …… hmotnost složky ve směsi m(r) …… hmotnost rozpouštědla m(s) + m(r) ...... hmotnost celé směsi m(c) Př. Při výrobě meruňkového kompotu se používá sladký nálev, který se připravuje rozpuštěním 0,5 kg cukru v 1 litru (1 l = 1 kg) vody.
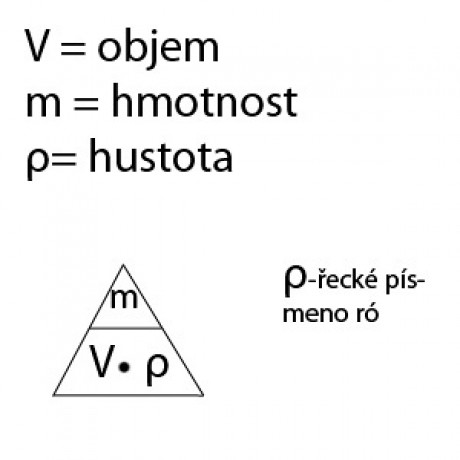
Vypočítej, kolika procentní roztok cukru ve vodě připravíme. m(s) = 0,5 kg m(r) = 1 kg w = ? (%) m(s) w = m(s) + m(r) 0,5 w = 0,5 + 1 w = 0,33 . 100% = 33% Připravili jsme 33% ní roztok cukru ve vodě. MOLÁRNÍ OBJEM Vm - objem jednoho molu látky. Vm = V / n Vm … molární objem Jednotka… dm3 /mol V … objem n … látkové množství 1 mol látky v plynném skupenství zaujímá za normálních podmínek objem V = 22,4 dm3 (22,4l). Normální podmínky jsou teplota t = 00 C, tlak p = 101 kPa. LÁTKOVÁ KONCENTRACE c Složení roztoků lze vyjádřit také veličinou látková koncentrace. Látková koncentrace vyjadřuje počet molů látky rozpuštěné v daném Používá se v chemii, lékařství, při sledování množství nebezpečných látek v životním prostředí,… c = n / V c … látková koncentrace Jednotka … mol/dm3 n … látkové množství V … objem M = m/n n = m/M c = n/V c = m / M . V Př. 0,015 molu hydroxidu draselného jsme nejprve rozpustili v malém množství destilované vody, pak roztok přelili do odměrné baňky a doplnili destilovanou vodou na objem 250 ml. Jaká je látková koncentrace hydroxidu draselného v tomto roztoku? n = 0,015 mol V = 250 ml = 0,250 l = 0,250 dm3 c = ? (mol/dm3 ) n c = V 0,015 c = 0,250 c = 0,06 mol/dm3 Látková koncentrace hydroxidu draselného v roztoku je 0,06 mol/dm3 .
Typy chemických vzorců Podle potřeby použití lze chemické vzorce zapisovat různými způsoby, které se liší mírou informací o struktuře uvažované látky. Stechiometrický vzorec (empirický) vyjadřuje stechiometrické složení dané sloučeniny, tj. určuje, které atomy a v jakém poměru jsou ve sloučenině obsaženy. Počet sloučených atom se vyznačuje číselným indexem vpravo dole za značkou prvku. číslice 1 se zpravidla neuvádí.
Vzorec se obvykle uzavírá do složených závorek. Příklady: {CH2} Zápis znamená, že v molekule dané sloučeniny je vázán uhlík s vodíkem v poměru potu atom 1:2, tedy např. C2H4 nebo C3H6 nebo C20H40 atd. {P2O5} Zápis znamená, že v molekule dané sloučeniny je vázán fosfor s kyslíkem v poměru potu atom 2:5, tedy např. P2O5 nebo P4O10. Molekulový vzorec (souhrnný) vyjadřuje nejen stechiometrické složení sloučeniny, ale i přesné poty vázaných atom. V mnoha případech je shodný se vzorcem stechiometrickým. Příklady: molekulový vzorec chemický název stechiometrický (empirický) vzorec NO2 (monomerní) oxid dusičitý {NO2} N2O4 dimerní oxid dusičitý {NO2} P2O5 monomerní oxid fosforečný {P2O5} P4O10 dimerní oxid fosforečný {P2O5} H2O voda {H2O} NaCl chlorid sodný {NaCl} Racionální (funkční) vzorec umožňuje zdůraznit přítomnost charakteristických atomových skupin, tzv. funkčních skupin v dané sloučenině. Představuje zjednodušenou formu strukturního vzorce.
Při jejich používání je třeba dodržovat určitá pravidla: – Funkční skupiny je možno pro větší přehlednost: a) uzavírat do kulatých závorek, např.: Ca(OH)2, CH3(CH2)3OH, (NH2)2 b) oddělovat vazebnou čárkou, např.: HO–Ca–OH, CH3–CH2–CH2–CH2–OH, H2N–NH2 – Je-li funkční skupina, molekula nebo ion koordinační, uvádí se v hranatých závorkách, např.: K2[PtCl6], K3[Fe(CN)6] – Vzorec molekuly vody v hydrátu se od vzorce základní sloučeniny odděluje tekou, která se te „plus“ nebo „krystaluje s“. Počet molekul se vyjádří arabskou číslicí před vzorcem (obvykle se od něj neodděluje mezerou). Např.: CuSO4 ⋅ 5H2O Strukturní (konstituční) vzorec zobrazuje, které atomy jsou navzájem spojeny, zpravidla však neudává prostorové uspořádání molekuly a nemusí uvádět ani násobnost vazeb.
Příklady: Typ vzorce: Název: stechiometrický molekulový funkční strukturní peroxid vodíku {HO} H2O2 HO–OH H−O−O−H kyselina sírová {H2SO4} H2SO4 H2SO4 H−O O \ / S / \ H−O O Jeho často užívanou formou je elektronový strukturní vzorec, který graficky vyjadřuje uspořádání valenčních elektron (vazebných i nevazebných) v atomu, iontu nebo molekule.
Parciální náboje na atomech 2 spojených kovalentní vazbou se vyznačují znaménky ⊕, , δ+, δ-, Kovalentní vazbu symbolizují čárky − (jednoduchá vazba), = (dvojná vazba), ≡ (trojná vazba) mezi sloučenými atomy. Příklady: oxid uhličitý voda fosfan oxid uhelnatý chlorovodík Geometrický (konfigurační) vzorec znázorňuje prostorové uspořádání atom, iont nebo molekul. oxid uhličitý voda fosfan oxid uhelnatý chlorovodík fluorid sírový Krystalochemický (koordinační) vzorec vyjadřuje koordinační čísla, tj. počet atom, iont nebo molekul, které bezprostředně obklopují určitý atom v krystalové struktuře. Koordinační čísla se zapisují ve tvaru zlomku (jejich podělením dostáváme odpovídající koeficient ve stechiometrickém vzorci).
Čitatel udává koordinační číslo prvního atomu (nebo iontu i molekuly), jmenovatel udává koordinační číslo druhého atomu (nebo iontu i molekuly). Význam koeficient si vysvětlíme na příkladech: 4/2 = 2, stechiometrický vzorec dané sloučeniny je tedy {SiO2}. Koordinační číslo Si je 4, atom Si je tedy obklopován třemi atomy O. Koordinační číslo O je 2, atom O je tedy obklopován dvěma atomy Si. 6/6 = 1, stechiometrický vzorec dané sloučeniny je tedy {NaCl}. Koordinační číslo Na je 6, atom Na je tedy obklopován šesti atomy Cl. Koordinační číslo Cl je 6, atom Cl je tedy obklopován šesti atomy Na.
objemu roztoku.